Simbolo dell’elemento: P
Numero atomico: 15
Config. elettronica: [Ne] 3s23p3
Isotopi naturali: 31P
Massa atomica: 30.97 uma
Densita: 1.82 g cm-3 (0°C, 1atm)
Punto di fusione: 44°C
Punto di ebollizione: 280°C
Elettronegativita: 2.10
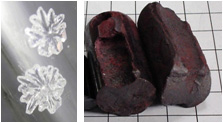
Cristalli di fosforo bianco e pezzi di fosforo rosso
Fosforo
Combustione del fosforo in ossigeno
La combustione del fosforo, in presenza di alta concentrazione di ossigeno, avviene molto più velocemente con una forte emissione di luce.
Combustione del fosforo
Il fosforo bianco è molto reattivo e può incendiarsi spontaneamente all’aria. Al contrario, il fosforo rosso è molto più stabile, non brucia spontaneamente ma può essere acceso con una fiamma. Nel filmato si osserva l’accensione di una piccola quantità di fosforo rosso: la fiamma generata viene successivamente spenta coprendola con un becher, ma quando si solleva il becher, anche se il fosforo sembra spento, dopo pochi istanti la fiamma ricompare. La difficoltà di spegnere la fiamma generata dal fosforo è dovuta alla conversione di una piccola quantità di fosforo rosso in fosforo bianco, che si infiamma spontaneamente a contatto con l’ossigeno dell’aria ed innesca di nuovo la combustione del fosforo rosso. Il fumo bianco che si osserva è dovuto alla formazione di anidride fosforica, di odore acre, che a contatto con l’umidità dell’aria genera acido fosforico.
