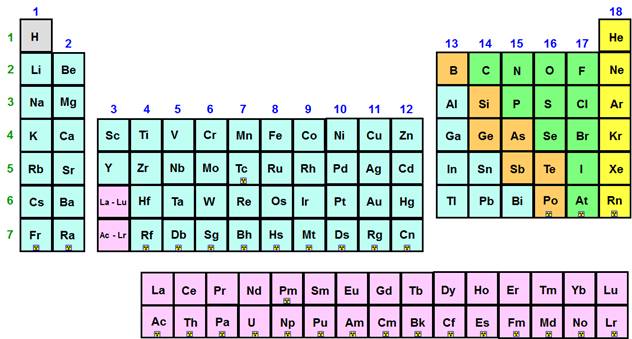
Introduzione alla tavola periodica
La tavola periodica è una distribuzione di tutti gli elementi
conosciuti, naturali e artificiali, basata sul numero atomico crescente quale
principio ordinatore. La ragione per la quale gli elementi sono organizzati in
tal modo è di inserirli tutti, con le loro differenti proprietà fisiche e
chimiche, in un modello logico. Disponendo il sodio sotto il litio e non a
fianco del fluoro, ed il potassio sotto il sodio in modo da iniziare un'altra
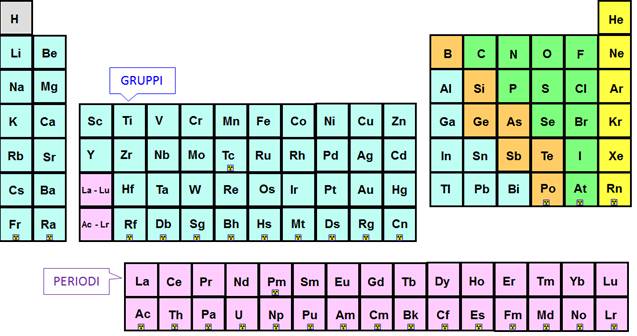
riga, e così via, le linee verticali contengono elementi chimicamente simili.
Queste linee verticali sono denominate GRUPPI.
Le linee orizzontali degli elementi sono invece denominate
PERIODI. L’insieme degli elementi del BLOCCO d, a volte denominati come metalli
di transizione, è presente fra i gruppi 2 e 13; tali elementi sono tra loro
spesso chimicamente simili. Gli elementi di alcuni gruppi esibiscono una
notevole somiglianza tra loro, come ad esempio nel gruppo 1, mentre in altri
gruppi gli elementi sono tra loro meno simili, come nel gruppo 4, ma ciascun
gruppo presenta un insieme comune di caratteristiche.
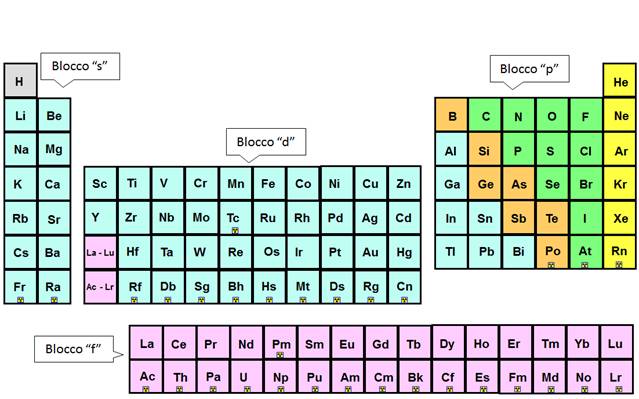
La tavola periodica è suddivisa in BLOCCHI.
- - Gli elementi del blocco “s” hanno la configurazione elettronica di valenza s1 o s2.
- - Gli elementi del blocco “p” hanno la configurazione elettronica di valenza da s2p1 fino a s2p6.
- - Gli elementi del blocco “d” hanno la configurazione elettronica di valenza in cui gli orbitali del guscio d sono incompleti.
- - Gli elementi del blocco “f” hanno la configurazione elettronica di valenza in cui gli orbitali del guscio f sono incompleti.
- - L'idrogeno occupa una posizione unica nella parte superiore della tavola periodica. Esso non appartiene a nessun gruppo.
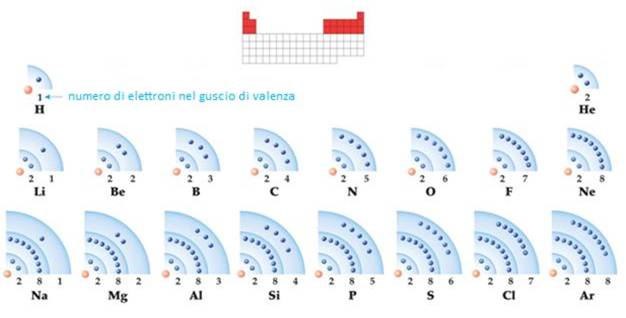
Tutti gli elementi di un gruppo hanno la stessa CONFIGURAZIONE DI VALENZA ma differenti numeri quantici principali. Il numero degli elettroni del guscio di valenza eguaglia il numero del gruppo. Il numero del periodo eguaglia il numero quantico principale del guscio di valenza.
Chimicamente, gli elementi nello stesso blocco esibiscono le
stesse caratteristiche generali. Ciò è più evidente nel blocco “s” i cui
elementi sono tutti i metalli con bassa elettronegatività.
Gli elementi del blocco “p” sono maggiormente differenziati,
e si passa da metalli quali l’alluminio a sinistra ai non-metalli come il cloro
a destra, attraverso i semimetalli o metalloidi, come il silicio al centro, con
un graduale cambiamento nel carattere chimico attraverso la tavola periodica. I
semimetalli o metalloidi si trovano approssimativamente in una linea diagonale
che va dal boro al tellurio. Il gruppo più a destra della tavola periodica è
quello dei “gas nobili”, elementi non metallici, praticamente non reattivi a
causa del guscio di valenza completo s2p6.
Gli elementi del blocco “d” sono spesso denominati metalli di
transizione, ma quelli del gruppo 12 (lo zinco, il cadmio e il mercurio) non
rientrano in questa descrizione. Gli elementi del blocco “d” sono in genere
considerati assieme poiché le differenze fra i gruppi sono molto meno evidenti
in questo blocco rispetto agli elementi del blocco “p”.
Gli elementi del blocco “f” sono tutti metalli. Quelli del 6°
periodo presentano caratteristiche fisiche e chimiche molto simili. Quelli del
7° periodo sono tutti radioattivi e, a parte il torio e l’uranio, sono tutti
artificiali.
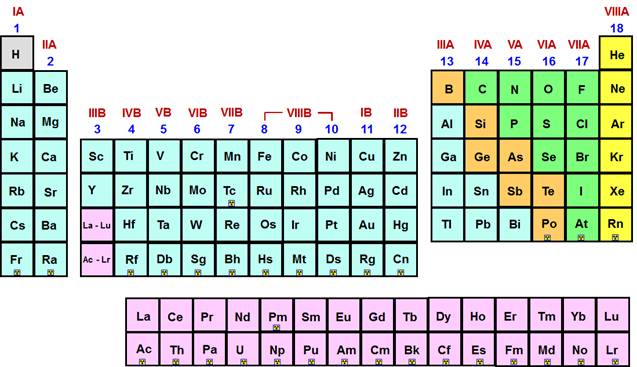
I gruppi della Tavola Periodica sono numerati da 1 a 18, in
base alle recenti raccomandazioni della IUPAC (International Union of Pure and
Applied Chemistry).
La
precedente numerazione dei gruppi era basati sui numeri romani da I a VIII
seguiti da una lettera (A per i gruppi dei blocchi “s” e “p”, B per i gruppi
del blocco “d”).
I periodi (righe orizzontali della tavola periodica) sono invece numerati da 1 a 7. Il primo periodo comprende idrogeno ed elio, il secondo va dal litio fino al neon (8 elementi), il terzo dal sodio fino all’argon (8 elementi). Dal quarto periodo vengono inclusi i metalli del blocco d, e si va dal potassio fino al cripto (18 elementi); analogamente il quinto periodo include 18 elementi, dal rubidio fino allo xeno. Il sesto periodo è costituito da ben 32 elementi, dal cesio fino al radon, compresi quelli del blocco d e i lantanidi (dal lantanio fino al lutezio). Infine, il settimo periodo è costituito, per ora, da 26 elementi, tutti radioattivi, dal francio fino all’elemento 112, battezzato Copernicio dalla IUPAC nel 2010.
A cura di: Riccardo Pettinari, Ivan Timokhin, Corrado Di Nicola, Claudio Pettinari, Fabio Marchetti (Responsabile PLS)
