Sviluppo storico della tavola periodica
I primi tentativi di
visualizzare le relazioni tra gli elementi furono focalizzati sulla loro
reattività e sulle coincidenze matematiche. Le “Tavole di Affinità” nel XVIII
secolo organizzavano gli elementi che reagivano tra loro in liste verticali.
Gli elementi che reagivano più vigorosamente con un dato elemento venivano
posti nella parte alta della lista, quelli con minore affinità invece nella
parte bassa.
All’inizio del XIX secolo
diversi chimici notarono che diversi gruppi di tre elementi chimicamente simili
mostravano una interessante relazione matematica. il peso atomico dell’elemento
mediano è approssimativamente la media dei pesi atomici degli altri due
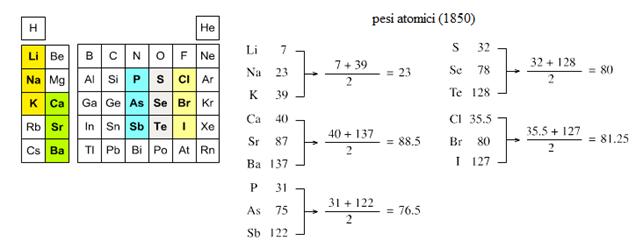
elementi. Ad esempio, nel 1817 il chimico tedesco Wolfgang Döbereiner evidenzio
l’esistenza di diversi raggruppamenti di tre elementi, che chiamò triadi, i
quali mostravano tra essi questa importante relazione numerica:

 Egli identificò i seguenti gruppi:
Egli identificò i seguenti gruppi:
- - litio, sodio e potassio
- - calcio, stronzio e bario
- - fosforo, arsenico e antimonio
- - zolfo, selenio e tellurio
- - cloro, bromo e iodio
Queste triadi, che corrispondono a parti dei gruppi della moderna tavola periodica, costituiscono il primo passo nei tentativi di organizzare gli elementi in un sistema che tenesse conto delle loro proprietà chimiche e rivelasse al tempo stesso le correlazioni fisiche.

 Dal 1860 vari scienziati superarono il concetto di triadi e iniziarono ad organizzare e proporre veri e propri sistemi periodici. Nel 1862 il geologo francese Alexandre-Émile Béguyer de Chancourtois estese l’idea di periodicità da due a tre dimensioni e realizzò il primo vero sistema periodico arrangiando gli elementi in una spirale continua in ordine di peso atomico crescente attorno ad un cilindro metallico. In tal modo gli elementi con proprietà simili, ad esempio ossigeno, zolfo e selenio, apparivano su linee verticali. Poiché il tellurio appariva nel centro della spirale, divenne noto come la “vite tellurica”. Le correlazioni periodiche possono essere visualizzate muovendo la vite in verticale verso il basso.
Dal 1860 vari scienziati superarono il concetto di triadi e iniziarono ad organizzare e proporre veri e propri sistemi periodici. Nel 1862 il geologo francese Alexandre-Émile Béguyer de Chancourtois estese l’idea di periodicità da due a tre dimensioni e realizzò il primo vero sistema periodico arrangiando gli elementi in una spirale continua in ordine di peso atomico crescente attorno ad un cilindro metallico. In tal modo gli elementi con proprietà simili, ad esempio ossigeno, zolfo e selenio, apparivano su linee verticali. Poiché il tellurio appariva nel centro della spirale, divenne noto come la “vite tellurica”. Le correlazioni periodiche possono essere visualizzate muovendo la vite in verticale verso il basso.
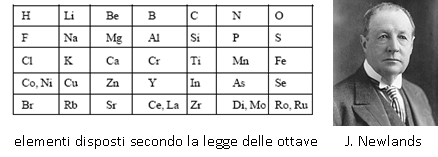 Nel 1863 e 1864 due chimici inglesi, John Newlands e William Olding pubblicarono indipendentemente nuove tavole periodiche basate sul peso atomico che disponevano gli elementi in gruppi con proprietà analoghe. In particolare Newlands notò che ogni elemento aveva proprietà simili a quelle degli elementi che stavano otto posti avanti e otto posti indietro (Legge delle ottave: l’ottavo elemento era una specie di ripetizione del primo, analogamente a quanto si verifica per l’ottava nota nella scala musicale).
Nel 1863 e 1864 due chimici inglesi, John Newlands e William Olding pubblicarono indipendentemente nuove tavole periodiche basate sul peso atomico che disponevano gli elementi in gruppi con proprietà analoghe. In particolare Newlands notò che ogni elemento aveva proprietà simili a quelle degli elementi che stavano otto posti avanti e otto posti indietro (Legge delle ottave: l’ottavo elemento era una specie di ripetizione del primo, analogamente a quanto si verifica per l’ottava nota nella scala musicale).
Un più eccentrico sistema periodico con struttura a spirale fu creato e proposto dal danese Gustavus Hinrichs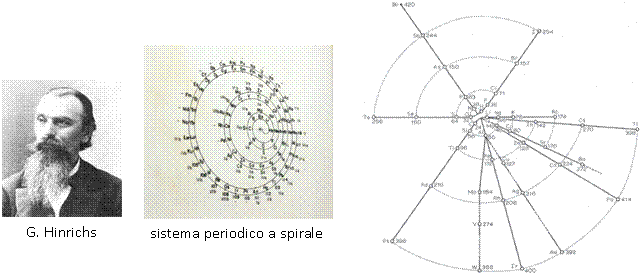 nel 1864. Hinrichs era intrigato dalle frequenze degli spettri atomici che, come le distanze planetarie, mostravano rapporti numerici interi. Sulla base di ciò Hinrichs concluse che gli spettri atomici dovessero essere quindi una indicazione delle dimensioni atomiche.
nel 1864. Hinrichs era intrigato dalle frequenze degli spettri atomici che, come le distanze planetarie, mostravano rapporti numerici interi. Sulla base di ciò Hinrichs concluse che gli spettri atomici dovessero essere quindi una indicazione delle dimensioni atomiche.
Il vero precursore di Mendeleev e della sua tavola, sia in termini cronologici che filosofici, fu però il chimico tedesco Julius Lothar Meyer, che nel 1864 presentò una tavola molto simile a quella che Mendeleev avrebbe sviluppato cinque anni più tardi, con gli elementi ordinati però in base alle proprietà fisiche piuttosto che chimiche.  Meyer aveva notato che, se si tracciava un grafico dei volumi atomici degli elementi in funzione dei pesi atomici, si otteneva una serie di onde che formavano vertici appuntiti in corrispondenza dei metalli alcalini, cioè sodio, potassio, rubidio e cesio.
Meyer aveva notato che, se si tracciava un grafico dei volumi atomici degli elementi in funzione dei pesi atomici, si otteneva una serie di onde che formavano vertici appuntiti in corrispondenza dei metalli alcalini, cioè sodio, potassio, rubidio e cesio.
La distanza tra due vertici consecutivi corrispondeva a un periodo della tavola degli elementi. In ogni periodo, oltre al volume atomico, subiva un'oscillazione anche un certo numero di altre proprietà fisiche. Per varie ragioni, però, la preminenza di Meyer nei libri di storia non ha mai eguagliato quella di Mendeleev.  Ci fu un inopportuno ritardo nella pubblicazione della sua tavola periodica nella versione più elaborata, ma un motivo decisivo risiede soprattutto nella esitazione di Meyer, a differenza di Mendeleev, di fare previsioni circa elementi ancora sconosciuti.
Ci fu un inopportuno ritardo nella pubblicazione della sua tavola periodica nella versione più elaborata, ma un motivo decisivo risiede soprattutto nella esitazione di Meyer, a differenza di Mendeleev, di fare previsioni circa elementi ancora sconosciuti.
Meyer e Mendeleev erano tra i giovani chimici che parteciparono al congresso di Karlsruhe nel 1860, ed entrambi furono impressionati dalla presentazione di Stanislao Cannizzaro dell’ipotesi di Amedeo Avogadro e dalla proposta che egli fornì sulla questione relativa alla determinazione dei pesi atomici. Per entrambi, il dover scrivere un libro di testo costituì un impeto allo sviluppo della tavola periodica, cioè trovare un modo di presentare ed organizzare più di 60 elementi conosciuti in un modo comprensibile. Nonostante i contributi scientifici di questi predecessori, e di Meyer soprattutto, all’idea di periodicità, Mendeleev rimane però l’indiscusso campione del sistema periodico quale difensore, divulgatore ed elaboratore dello stesso. Egli osservò una regolarità nella variazione della valenza degli elementi e del loro comportamento chimico: ordinando gli elementi in base al peso atomico crescente, la valenza aumentava e diminuiva, dando luogo a periodi.
che egli fornì sulla questione relativa alla determinazione dei pesi atomici. Per entrambi, il dover scrivere un libro di testo costituì un impeto allo sviluppo della tavola periodica, cioè trovare un modo di presentare ed organizzare più di 60 elementi conosciuti in un modo comprensibile. Nonostante i contributi scientifici di questi predecessori, e di Meyer soprattutto, all’idea di periodicità, Mendeleev rimane però l’indiscusso campione del sistema periodico quale difensore, divulgatore ed elaboratore dello stesso. Egli osservò una regolarità nella variazione della valenza degli elementi e del loro comportamento chimico: ordinando gli elementi in base al peso atomico crescente, la valenza aumentava e diminuiva, dando luogo a periodi.
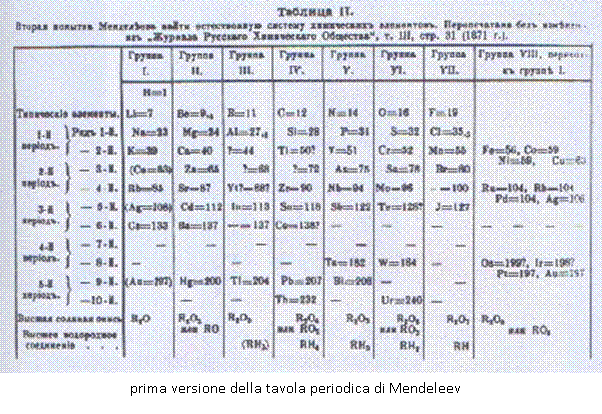
La versione di Mendeleev della tavola periodica produsse un enorme impatto sulla comunità scientifica, sia a quel tempo che successivamente. Nell’immaginazione popolare il sistema periodico è invariabilmente e legittimamente connesso al suo nome, allo stesso modo in cui la teoria dell’evoluzione è connessa al nome di Darwin e la teoria della relatività al nome di Einstein.
Dalle sostanze semplici agli elementi astratti
 Organizzando gli elementi come egli fece, Mendeleev si prese una pausa sulla centenaria questione dello status filosofico degli elementi. A differenza dei suoi contemporanei, Mendeleev rifiutò il suggerimento che il sistema periodico implicasse l’esistenza di una qualche forma primaria di materia, della quale erano composti tutti gli elementi. Egli affermò che tutti gli elementi fossero strettamente individuali, indistruttibili e irriducibili, ma accettò l’apparente sfida posta dalle reazioni chimiche. Consideriamo il familiare esempio del cloruro di sodio: il comune sale da cucina bianco non sembra contenere il tossico sodio metallico grigio o il tossico gas cloro verde. Aristotele aveva affermato che tutta la materia fosse composta di qualche combinazione di quattro elementi astratti: fuoco, terra, acqua ed aria. Nonostante tali elementi non fossero individualmente osservabili, le loro relative proporzioni all’interno di una specifica sostanza erano alla base delle proprietà della sostanza stessa.
Organizzando gli elementi come egli fece, Mendeleev si prese una pausa sulla centenaria questione dello status filosofico degli elementi. A differenza dei suoi contemporanei, Mendeleev rifiutò il suggerimento che il sistema periodico implicasse l’esistenza di una qualche forma primaria di materia, della quale erano composti tutti gli elementi. Egli affermò che tutti gli elementi fossero strettamente individuali, indistruttibili e irriducibili, ma accettò l’apparente sfida posta dalle reazioni chimiche. Consideriamo il familiare esempio del cloruro di sodio: il comune sale da cucina bianco non sembra contenere il tossico sodio metallico grigio o il tossico gas cloro verde. Aristotele aveva affermato che tutta la materia fosse composta di qualche combinazione di quattro elementi astratti: fuoco, terra, acqua ed aria. Nonostante tali elementi non fossero individualmente osservabili, le loro relative proporzioni all’interno di una specifica sostanza erano alla base delle proprietà della sostanza stessa.
 Antoine-Laurent Lavoisier ed i suoi contemporanei misero in dubbio questo modo di vedere nel XVII secolo introducendo i nuovi concetti di sostanze semplici. Essi crearono una lista di 37 sostanze semplici che potevano essere isolate dalla decomposizione di sostanze composte e che non potevano essere ulteriormente decomposti con alcun metodo sino ad allora conosciuto.
Antoine-Laurent Lavoisier ed i suoi contemporanei misero in dubbio questo modo di vedere nel XVII secolo introducendo i nuovi concetti di sostanze semplici. Essi crearono una lista di 37 sostanze semplici che potevano essere isolate dalla decomposizione di sostanze composte e che non potevano essere ulteriormente decomposti con alcun metodo sino ad allora conosciuto.
Più che in tutte le altre scoperte del sistema periodico, Mendeleev fu interessato allo status filosofico degli elementi. All’inizio del primo volume del suo trattato “Principi di Chimica” (Osnovy Khimii, prima edizione, Saint Petersburg, 1869) egli scrisse: " È utile in questo senso fare una netta distinzione fra la concezione di un elemento come sostanza omogenea separata e come una materiale ma invisibile parte di un composto". Per Mendeleev un elemento era una entità essenzialmente non osservabile ma che costituiva l’essenza interna dei corpi semplici. Mentre un particolare elemento doveva essere considerato come inalterabile, il suo corrispondente aspetto di corpo semplice poteva assumere molte forme, come carbone, diamante e grafite nel caso del carbonio. La sua tavola periodica classificava elementi astratti, non semplici sostanze. Il genio di Mendeleev risiede nel fatto che egli seppe riconoscere che, come era l’elemento in senso astratto a sopravvivere intatto nel corso della formazione dei composti, così il peso atomico era l’unica quantità che sopravviveva nelle quantità misurabili. Egli fece perciò la scelta di associare queste due caratteristiche: un elemento doveva essere caratterizzato dal suo peso atomico. In pratica un elemento astratto acquisiva un attributo misurabile che rimaneva inalterato in tutte le sue combinazioni chimiche. Qui vi è la profonda giustificazione nell’uso del peso atomico come principio di classificazione degli elementi, a differenza di tutti gli altri precursori al sistema periodico.
Un nuovo gruppo di elementi
 P. Janssen e J. N. Lockyer scoprirono nel 1868 un nuovo elemento attraverso l’osservazione della cromosfera del sole, e lo chiamarono elio dalla parola greca helios (sole), ma a quel tempo non era possibile alcuna analisi chimica, e solo in seguito fu accertato che l’elio era un gas nobile non reattivo chimicamente.
Nel 1895 Lord Rayleigh scoprì che campioni di azoto dell’aria avevano una differente densità rispetto all’azoto ottenuto da reazioni chimiche, e ipotizzò che ciò fosse dovuto alla presenza di un altro gas. Assieme a William Ramsay dell’University College di Londra furono condotti esperimenti che portarono all’isolamento di un nuovo elemento, l’argo (dal greco argos, inattivo). Con tale scoperta e il successivo isolamento dell’elio per riscaldamento del minerale cleveite, essi compresero che vi era una intera classe di gas nuovi, non ancora catalogati nella tavola periodica.
P. Janssen e J. N. Lockyer scoprirono nel 1868 un nuovo elemento attraverso l’osservazione della cromosfera del sole, e lo chiamarono elio dalla parola greca helios (sole), ma a quel tempo non era possibile alcuna analisi chimica, e solo in seguito fu accertato che l’elio era un gas nobile non reattivo chimicamente.
Nel 1895 Lord Rayleigh scoprì che campioni di azoto dell’aria avevano una differente densità rispetto all’azoto ottenuto da reazioni chimiche, e ipotizzò che ciò fosse dovuto alla presenza di un altro gas. Assieme a William Ramsay dell’University College di Londra furono condotti esperimenti che portarono all’isolamento di un nuovo elemento, l’argo (dal greco argos, inattivo). Con tale scoperta e il successivo isolamento dell’elio per riscaldamento del minerale cleveite, essi compresero che vi era una intera classe di gas nuovi, non ancora catalogati nella tavola periodica.  Ramsay continuò a cercare questi gas usando il metodo della distillazione frazionata per la separazione dell’aria liquida nei suoi componenti. Nel 1898 egli scoprì ed isolò gli elementi cripto, neon e xeno, che chiamò in base ai termini greci kryptos (nascosto) neos (nuovo) e xenos (straniero). Il radon (dalla combinazione di “radium emanation”, poiché derivava dal decadimento alfa del radio) fu identificato per la prima volta nel 1898 da F. E. Dorn, ma non fu considerato un gas nobile fino al 1904, quando si comprese che le sue caratteristiche chimiche erano simili a quelle degli altri gas nobili. Nel 1902, avendo ormai accettato l’evidenza di elementi come l’elio e l’argon, Mendeleev incluse questi elementi gassosi come un nuovo gruppo, il gruppo 0, nella tavola periodica. Rayleigh e Ramsay ricevettero nel 1904 rispettivamente i premi Nobel nella Fisica e nella Chimica per le loro scoperte dei gas nobili.
Ramsay continuò a cercare questi gas usando il metodo della distillazione frazionata per la separazione dell’aria liquida nei suoi componenti. Nel 1898 egli scoprì ed isolò gli elementi cripto, neon e xeno, che chiamò in base ai termini greci kryptos (nascosto) neos (nuovo) e xenos (straniero). Il radon (dalla combinazione di “radium emanation”, poiché derivava dal decadimento alfa del radio) fu identificato per la prima volta nel 1898 da F. E. Dorn, ma non fu considerato un gas nobile fino al 1904, quando si comprese che le sue caratteristiche chimiche erano simili a quelle degli altri gas nobili. Nel 1902, avendo ormai accettato l’evidenza di elementi come l’elio e l’argon, Mendeleev incluse questi elementi gassosi come un nuovo gruppo, il gruppo 0, nella tavola periodica. Rayleigh e Ramsay ricevettero nel 1904 rispettivamente i premi Nobel nella Fisica e nella Chimica per le loro scoperte dei gas nobili.
Il problema degli isotopi
 Verso la fine della vita di Mendeleev un crescente numero di evidenze sperimentali iniziava a sfidare la sua concezione sulla natura degli elementi. Alcune scoperte rivoluzionarie nella fisica mostravano che gli atomi dei diversi elementi erano infatti riducibili ad alcuni componenti fondamentali della materia: protoni, neutroni ed elettroni. Soprattutto, vi era addirittura l’evidenza che certi elementi potevano essere trasformati in altri elementi attraverso il fenomeno della radioattività. Nel 1879 J. J. Thomson identificò gli elettroni come particelle costituenti I raggi catodici. Ripetendo i suoi esperimenti con raggi catodici prodotti da differenti elementi, egli concluse che in tutti i casi veniva prodotto lo stesso tipo di particella, e quindi tale particella doveva essere un costituente fondamentale di tutta la materia. Poco tempo dopo Henri Becquerel e i coniugi Curie iniziarono ad esplorare il fenomeno della radioattività.
Verso la fine della vita di Mendeleev un crescente numero di evidenze sperimentali iniziava a sfidare la sua concezione sulla natura degli elementi. Alcune scoperte rivoluzionarie nella fisica mostravano che gli atomi dei diversi elementi erano infatti riducibili ad alcuni componenti fondamentali della materia: protoni, neutroni ed elettroni. Soprattutto, vi era addirittura l’evidenza che certi elementi potevano essere trasformati in altri elementi attraverso il fenomeno della radioattività. Nel 1879 J. J. Thomson identificò gli elettroni come particelle costituenti I raggi catodici. Ripetendo i suoi esperimenti con raggi catodici prodotti da differenti elementi, egli concluse che in tutti i casi veniva prodotto lo stesso tipo di particella, e quindi tale particella doveva essere un costituente fondamentale di tutta la materia. Poco tempo dopo Henri Becquerel e i coniugi Curie iniziarono ad esplorare il fenomeno della radioattività.
 Nel 1902 Ernest Rutherford suggerì che le reazioni radioattive avessero la capacità di trasformare alcuni elementi in elementi completamente differenti. Egli ed il suo collega Frederick Soddy descrissero questo nuovo fenomeno come la trasmutazione chimica, evocando in tal modo il vecchio sogno degli alchimisti.
Come se la trasmutazione non bastasse, la scoperta degli isotopi complicò l’intero sistema periodico. Il fallimento degli scienziati di separare i radioisotopi con metodi chimici minacciava sia la tradizionale nozione di elemento sia l’utilità del peso atomico come caratteristica dell’elemento stesso.
Nel 1902 Ernest Rutherford suggerì che le reazioni radioattive avessero la capacità di trasformare alcuni elementi in elementi completamente differenti. Egli ed il suo collega Frederick Soddy descrissero questo nuovo fenomeno come la trasmutazione chimica, evocando in tal modo il vecchio sogno degli alchimisti.
Come se la trasmutazione non bastasse, la scoperta degli isotopi complicò l’intero sistema periodico. Il fallimento degli scienziati di separare i radioisotopi con metodi chimici minacciava sia la tradizionale nozione di elemento sia l’utilità del peso atomico come caratteristica dell’elemento stesso.
 Riflettendo su tale situazione, nel 1911 Soddy scrisse: "Chemical homogeneity is no longer a guarantee that any supposed element is not a mixture of several different atomic weights, or that any atomic weight is not merely a mean number. The constancy of atomic weight, whatever the source of the material, is not a complete proof of homogeneity."
Riflettendo su tale situazione, nel 1911 Soddy scrisse: "Chemical homogeneity is no longer a guarantee that any supposed element is not a mixture of several different atomic weights, or that any atomic weight is not merely a mean number. The constancy of atomic weight, whatever the source of the material, is not a complete proof of homogeneity." 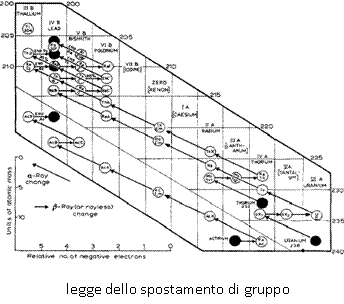 (l’omogeneità chimica non è più una garanzia che un certo elemento non sia una miscela di diversi pesi atomici, o che un certo peso atomico non sia semplicemente un valore medio. La costanza del peso atomico, qualunque sia la sorgente del materiale, non è una prova conclusiva della sua omogeneità).
Questa situazione iniziò a chiarirsi quando Soddy e Kasimir Fajans, un chimico polacco, suggerirono in modo indipendente ciò che divenne noto come la legge dello spostamento di gruppo nel 1913. Entrambi trovarono che l’emissione di una particella alfa da un elemento produceva un nuovo elemento che si trovava due posti a sinistra nella tavola periodica, mentre l’emissione di una particella beta risultava nella formazione di un elemento che si trovava spostato di una posizione a destra.
Ad esempio, se un atomo di uranio-235 subisce un decadimento alfa, esso forma un atomo di torio-231; analogamente, un atomo di attinio-230 può subire un decadimento beta formando un atomo di torio-230. Oggi noi riconosceremmo entrambi i prodotti dei due suddetti decadimenti come atomi dello stesso elemento aventi differenti pesi atomici, ma a quel tempo il problema dell’identità elementare non era stato ancora ben definito.
(l’omogeneità chimica non è più una garanzia che un certo elemento non sia una miscela di diversi pesi atomici, o che un certo peso atomico non sia semplicemente un valore medio. La costanza del peso atomico, qualunque sia la sorgente del materiale, non è una prova conclusiva della sua omogeneità).
Questa situazione iniziò a chiarirsi quando Soddy e Kasimir Fajans, un chimico polacco, suggerirono in modo indipendente ciò che divenne noto come la legge dello spostamento di gruppo nel 1913. Entrambi trovarono che l’emissione di una particella alfa da un elemento produceva un nuovo elemento che si trovava due posti a sinistra nella tavola periodica, mentre l’emissione di una particella beta risultava nella formazione di un elemento che si trovava spostato di una posizione a destra.
Ad esempio, se un atomo di uranio-235 subisce un decadimento alfa, esso forma un atomo di torio-231; analogamente, un atomo di attinio-230 può subire un decadimento beta formando un atomo di torio-230. Oggi noi riconosceremmo entrambi i prodotti dei due suddetti decadimenti come atomi dello stesso elemento aventi differenti pesi atomici, ma a quel tempo il problema dell’identità elementare non era stato ancora ben definito.
 Nel 1913, studiando I’interazione di fasci di elettroni con differenti elementi, Henry Moseley individuò una relazione tra le frequenze dei raggi X emessi e le cariche nucleari (legge di Moseley), in corrispondenza della posizione degli elementi nella tavola periodica. Egli assegnò i numeri atomici agli elementi e comprese che proprietà chimiche simili ricorrono periodicamente quando gli elementi vengono disposti in funzione del loro numero atomico crescente. Il suo contributo fu fondamentale per poter stabilire con certezza che nessun altro gruppo di elementi potesse essere in futuro eventualmente scoperto tra quelli già noti, come era avvenuto qualche anno prima con i gas nobili. Ciò sarebbe infatti potuto avvenire solo con ipotetici elementi con numeri atomici frazionari, la qual cosa non è ovviamente possibile.
Nel 1913, studiando I’interazione di fasci di elettroni con differenti elementi, Henry Moseley individuò una relazione tra le frequenze dei raggi X emessi e le cariche nucleari (legge di Moseley), in corrispondenza della posizione degli elementi nella tavola periodica. Egli assegnò i numeri atomici agli elementi e comprese che proprietà chimiche simili ricorrono periodicamente quando gli elementi vengono disposti in funzione del loro numero atomico crescente. Il suo contributo fu fondamentale per poter stabilire con certezza che nessun altro gruppo di elementi potesse essere in futuro eventualmente scoperto tra quelli già noti, come era avvenuto qualche anno prima con i gas nobili. Ciò sarebbe infatti potuto avvenire solo con ipotetici elementi con numeri atomici frazionari, la qual cosa non è ovviamente possibile.
 Nel 1919 Francis William Aston dimostrò attraverso la spettrografia di massa, che la gran parte degli elementi si presenta come miscele di isotopi. I pesi atomici determinati per mezzo delle analisi chimiche erano perciò realmente la media dei pesi atomici di tutti gli isotopi di uno stesso elemento. Inoltre, le posizioni anomale di certi elementi in base al peso atomico, risultavano invece appropriate se si faceva riferimento al numero atomico.
Nel 1919 Francis William Aston dimostrò attraverso la spettrografia di massa, che la gran parte degli elementi si presenta come miscele di isotopi. I pesi atomici determinati per mezzo delle analisi chimiche erano perciò realmente la media dei pesi atomici di tutti gli isotopi di uno stesso elemento. Inoltre, le posizioni anomale di certi elementi in base al peso atomico, risultavano invece appropriate se si faceva riferimento al numero atomico.
 La scoperta della trasmutazione chimica attraverso il decadimento radioattivo minò alle basi l’utilità di un sistema periodico basato sul peso atomico. La via d’uscita fu trovata proprio usando il numero atomico piuttosto che il peso atomico come principio organizzatore. In particolare la scoperta dell’elettrone permise ai chimici di individuare le connessioni tra la struttura fisica dell’atomo e il comportamento periodico. Come i modelli atomici più sofisticati avrebbero spiegato in seguito, molte delle proprietà chimiche degli elementi sono determinate dal numero di elettroni di valenza, cioè del guscio più esterno. Il chimico austriaco Fritz Paneth propose così di campionare gli elementi in base al numero atomico, piuttosto che al peso atomico, come caratteristica primaria degli elementi. Egli assieme al chimico ungherese Gyorgy Hevsy, mostrò che le proprietà chimiche degli isotopi di uno stesso elemento erano identiche. I chimici potevano perciò considerare gli isotopi di ciascun elemento come la stessa sostanza semplice, nonostante gli atomi individuali potessero apparire sotto differenti forme isotopiche.
La scoperta della trasmutazione chimica attraverso il decadimento radioattivo minò alle basi l’utilità di un sistema periodico basato sul peso atomico. La via d’uscita fu trovata proprio usando il numero atomico piuttosto che il peso atomico come principio organizzatore. In particolare la scoperta dell’elettrone permise ai chimici di individuare le connessioni tra la struttura fisica dell’atomo e il comportamento periodico. Come i modelli atomici più sofisticati avrebbero spiegato in seguito, molte delle proprietà chimiche degli elementi sono determinate dal numero di elettroni di valenza, cioè del guscio più esterno. Il chimico austriaco Fritz Paneth propose così di campionare gli elementi in base al numero atomico, piuttosto che al peso atomico, come caratteristica primaria degli elementi. Egli assieme al chimico ungherese Gyorgy Hevsy, mostrò che le proprietà chimiche degli isotopi di uno stesso elemento erano identiche. I chimici potevano perciò considerare gli isotopi di ciascun elemento come la stessa sostanza semplice, nonostante gli atomi individuali potessero apparire sotto differenti forme isotopiche.
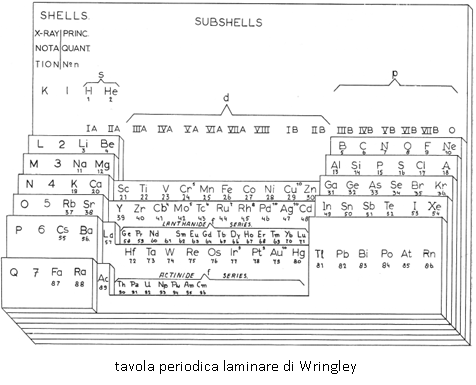
 Negli anni ’20 era ormai chiaro che il numero atomico fosse la proprietà atomica più importante nel determinare le caratteristiche chimiche degli elementi e fiorirono vari sistemi periodici con diverse forme, ma tutti con il numero atomico come principio ordinatore, come ad esempio quello proposto da Niels Bohr nel 1922. Negli anni successivi furono proposte altre forme molto più simili a quella attuale, come ad esempio la tavola periodica laminare di Wringley.
Negli anni ’20 era ormai chiaro che il numero atomico fosse la proprietà atomica più importante nel determinare le caratteristiche chimiche degli elementi e fiorirono vari sistemi periodici con diverse forme, ma tutti con il numero atomico come principio ordinatore, come ad esempio quello proposto da Niels Bohr nel 1922. Negli anni successivi furono proposte altre forme molto più simili a quella attuale, come ad esempio la tavola periodica laminare di Wringley.
Infine, lo sviluppo della quantomeccanica e il principio dell’aufbau (il riempimento degli orbitali) permisero di comprendere ed organizzare anche tutti gli elementi ora indicati come lantanidi e attinidi, per i quali vi è il progressivo riempimento del guscio di orbitali f, in un blocco a parte. La IUPAC propose poi di separare i 15 lantanidi, La-Lu, ed i 15 attinidi, Ac-Lr, lasciando un spazio vuoto nel 3° periodo, sotto lo scandio e l’ittrio. E’ interessante notare come già nel 1905 Alfred Werner, pur utilizzando come principio ordinatore ancora il peso atomico, propose una tavola periodica la cui forma è già molto più simile a quella della moderna tavola periodica, in cui i periodi dei metalli lantanidi e attinidi sono correttamente inseriti prima del blocco dei metalli di transizione.


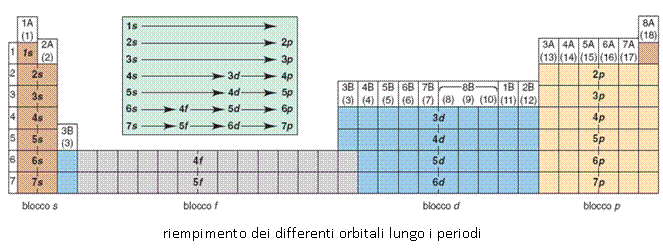
Fu P. Pfeiffer nel 1920 a modificare la tavola periodica di Werner spostando i lantanidi, assieme al torio e all’uranio, al di sotto dell’ultimo periodo, in una singola riga, ma in pratica in una posizione analoga a quanto normalmente proposto nella moderna tavola periodica.
A cura di: Riccardo Pettinari, Ivan Timokhin, Corrado Di Nicola, Claudio Pettinari, Fabio Marchetti (Responsabile PLS)
